歐盟自由銷售證書申請流程
- 時間:2022-06-09作者:上海沙格企業管理咨詢有限公司瀏覽:1047
上海沙格企業管理咨詢有限公司專注于CE,MDR認,MDR,CE認,IVDR,歐代,EU2017/745認,2017/746,EC,REP,CE技術文件,CE第四版臨床評估報告.SUNGO,EN,455,UK,EN12184,清洗驗,FDA驗廠等, 歡迎致電 13818104617
詞條
詞條說明
隨著世界經濟的發展,貿易水平的進一步提升,中國越來越多的企業不再僅僅立足于國內市場,而是希望將自己產品更多的走向世界。在進入海外市場的時候,各個國家也會為這些進口商設立很多的貿易壁壘:關稅壁壘,技術壁壘......技術壁壘就是我們經常說的認的要求,就是希望進入他們國家的企業,滿足當地法規的要求方可進入。這樣,當你開發了這個國家,做了他們的認,如果你開發其他國家,你還是需要申請新的認。成本越來
醫療器械FDA 510(k)注冊,因其相應FD&C Act第510章節,故通常稱510(K)注冊。510(k)為醫療器械在美國上市的主要途徑之一,絕大多數的II類醫療器械和部分I類、III類醫療器械通過此途徑清關上市。對510(k)注冊文件所必須包含的信息,FDA有一個基本的要求,其內容大致如下16個方面:? ?1) 申請函,此部分應包括申請人(或聯系人)和企業的基本信
Q:MDR何時生效?A:2017年5月5日,歐盟官方正式發布了歐盟醫療器械法規(MDR)。2017年5月25日,MDR正式生效。醫療器械指令MDD(93/42/EEC)和有源植入類醫療器械指令AIMDD(90/385/EEC)被醫療器械法規MDR(EU 2017/745)取代,法規過渡期為3年。制造商應在過渡期內較新技術文件和流程以滿足法規要求。具體可以參閱法規Article120中若干過渡條款的
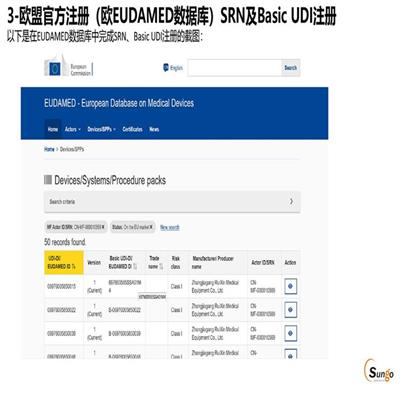
一、什么是UDI? 一器械標識(Unique Device Identification,縮寫UDI)是美國FDA建立的”特殊醫療器械的識別系統”,是對醫療器械在其整個生命周期賦予的身份標識,是其在產品供應鏈中的一“身份”。主要是一個由數字或字母組成的編碼。由器械識別碼(DI)和生產識別碼(PI)組成。器械標識DI屬于靜態信息,它是醫療器械產品在供應鏈中的身份標識,可作為進入數據庫查詢該產
聯系方式 聯系我時,請告知來自八方資源網!
公司名: 上海沙格企業管理咨詢有限公司
聯系人: 袁小姐
電 話: 021-68597208
手 機: 13818104617
微 信: 13818104617
地 址: 上海金山石化松南支路48號-826座
郵 編:
相關推薦
相關閱讀
1、本信息由八方資源網用戶發布,八方資源網不介入任何交易過程,請自行甄別其真實性及合法性;
2、跟進信息之前,請仔細核驗對方資質,所有預付定金或付款至個人賬戶的行為,均存在詐騙風險,請提高警惕!
- 聯系方式
- 相關企業
- 遼寧中益嘉泰**有限公司
- 杭州安恒達管理咨詢有限公司
- 鄭州林奧企業管理咨詢有限公司
- 天津博雋供應鏈管理有限公司
- 成都思培安信息技術有限公司
- 江蘇凡睿管理咨詢有限公司
- 湖北華思企業管理有限公司
- 北京宏易管理咨詢有限公司
- 重慶博視知識產權服務有限公司
- 青島劉小幫企業管理咨詢有限公司
- 商家產品系列
- 市場調研
- 技術咨詢
- 咨詢
- 一體化氣浮機咨詢
- 心理咨詢師報名條件
- 心理咨詢師培訓中心
- 心理咨詢師輔導
- 二級心理咨詢師工資
- 電商策劃咨詢
- 咨詢NM500耐磨板
- 山西心理咨詢名師
- 廣州天河財務咨詢
- 天河財務咨詢
- 天河財務咨詢公司
- 廣州財務咨詢
- 廣州財務咨詢公司
- 室內環保咨詢服務
- 煙臺裝修咨詢
- 皮帶輸送機咨詢
- 企業秀咨詢華企立方張小姐
- 土工膜價格咨詢
- 武漢環保咨詢公司
- 西北工業大學在線咨詢報名
- 四川法律援助咨詢平臺
- 薩提亞心理咨詢機構
- 薩提亞心理咨詢工作坊
- 薩提亞心理咨詢師
- 薩提亞心理咨詢工作室
- 鋼化玻璃咨詢廠家
- 咨詢NIPPONMUKI
- 產品推薦
- 資訊推薦